| শ্ৰেণী (Class) | নৱম শ্ৰেণীৰ (IX) |
| বিষয় | বিজ্ঞান (Science) |
| পাঠ (Lesson) | পৰমাণু গঠন |
| অধ্যায় (Chapter) | অধ্যায় ১ |
| মাধ্যম (Medium) | অসমীয়া |
| পাঠ্যক্ৰম | ছেবা (SEBA ) |
| ৱেবছাইটৰ নাম | Assamweb.in |
প্ৰশ্ন 1: কেনেল ৰশ্মি কি?
উত্তৰ: কেনেল ৰশ্মি হ’ল গেছৰ বিদ্যুৎ মােক্ষণৰ সময়ত উৎপন্ন হােৱা এক ধনাত্মক আধানযুক্ত ৰশ্মি। ইয়াক কেথডৰ ছিদ্ৰৰ মাজেৰে পাৰ হৈ যায়। এই ৰশ্মি ধনাত্মক আধানযুক্ত প্ৰটনৰ দ্বাৰা গঠিত হয়।
প্ৰশ্ন 2: পৰমাণু এটাত থকা প্ৰটন আৰু এটা ইলেক্ট্রন থাকিলে ই কোনাে আধান বহন কৰিবনে নকৰে?
উত্তৰ: এটা ইলেক্ট্রন ঋণাত্মকভাৱে আহিত, আৰু এটা প্ৰটন ধনাত্মকভাৱে আহিত। গতিকে, সিহঁতে বহন কৰা আধানৰ পৰিমাণ সমান হয়। সেইবাবে, এটা পৰমাণুত থকা প্ৰটন আৰু ইলেক্ট্রনে কোনাে ধৰণৰ আধান বহন নকৰে।
প্ৰশ্ন 3: থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণু এটা সামগ্রিকভাৱে কেনেদৰে প্ৰশম হয় ব্যাখ্যা কৰা।
উত্তৰ: থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে, এটা পৰমাণুৰ ধনাত্মক আৰু ঋণাত্মক আধান সমান মানৰ। সেইবাবে পৰমাণু এটা বৈদ্যুতিকভাৱে প্ৰশম হয়।
প্ৰশ্ন 4: ৰাডাৰফ ‘র্ডৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণুৰ নিউক্লিয়াছত কোনটো উপ-পাৰমাণৱিক কণা থাকে?
উত্তৰ: ৰাডাৰফ ‘র্ডৰ পৰমাণুৰ আৰ্হিৰ মতে, পৰমাণুৰ নিউক্লিয়াছত প্ৰটন (proton) থাকে।
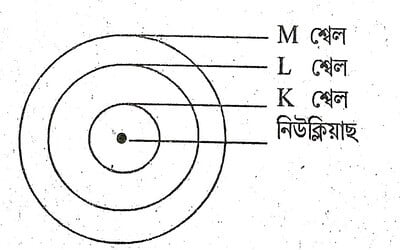
প্ৰশ্ন 5: তিনিটা খেলৰে সৈতে ব’ৰৰ পৰমাণুৰ আৰ্হিৰ এটা চিত্র অংকণ কৰা।
উত্তৰ: ব’ৰৰ পৰমাণুৰ আৰ্হি অনুসৰি, পৰমাণু এটাত নিউক্লিয়াছৰ চাৰিওফালে তিনিটা শক্তিৰ স্তৰ (K, L, M) থাকে। ইলেক্ট্রনবোৰ এই শক্তিৰ স্তৰবোৰত ঘূৰি থাকে। চিত্র হিচাপে নিউক্লিয়াছক কেন্দ্ৰত আৰু শক্তিৰ স্তৰক বৃত্তাকাৰ পথত দেখুওৱা হয়।
প্ৰশ্ন 6: যদি α-কণা বিছুৰণ পৰীক্ষাটোত সােণৰ পাতৰ সলনি আন ধাতুৰ পাত ব্যৱহাৰ কৰা হয়। তেনেহ’লে কি দেখা যাব বুলি ভাৱা ?
উত্তৰ:
সােণৰ পাতৰ সলনি আন ধাতু ব্যৱহাৰ কৰিলে প্রায় একে ফল পােৱা যাৱ। কিন্তু, সকলাে ধাতুৱে ঘাতসহনশীল নহয় যাৰ বাবে অতি পাতল পাতলৈ ৰূপান্তৰ কৰিব নােৱাৰি। অতি পাতল পাতৰ মাজেৰেহে α কণা সহজে বিছুৰণ কৰিব পাৰি।
প্ৰশ্ন 7: পৰমাণুৰ তিনিটা উপ-পাৰমাণৱিক কণাৰ নাম লিখা।
উত্তৰ: পৰমাণুৰ তিনিটা উপ-পাৰমাণৱিক কণাৰ নাম হ’ল—
- নিউট্রন,
- প্ৰটন,
- ইলেক্ট্রন।
প্ৰশ্ন 8: হিলিয়াম পৰমাণুৰ পাৰমাণৱিক ভৰ 4u আৰু ইয়াৰ নিউক্লিয়াছত দুটা প্ৰটন আছে। ইয়াত কিমানটা নিউট্রন থাকিব?
উত্তৰ: পৰমাণু এটাৰ ভৰ পৰমাণুটোত থকা প্ৰটন আৰু নিউট্রনৰ ভৰৰ সমান। যিহেতু প্ৰটন দুটা আছে, গতিকে নিউট্রনো দুটা থাকিব।
প্ৰশ্ন 9: কার্বন আৰু ছডিয়াম পৰমাণুত ইলেক্ট্রন বিতৰণ দেখুওৱা।
উত্তৰ:
- কার্বন (C):
পাৰমাণৱিক সংখ্যা = 6
ইলেক্ট্রন বিতৰণ = 2, 4 - ছডিয়াম (Na):
পাৰমাণৱিক সংখ্যা = 11
ইলেক্ট্রন বিতৰণ = 2, 8, 1
প্ৰশ্ন 10: পৰমাণু এটাৰ K আৰু L খেলবােৰ পূৰ্ণ হৈ থাকিলে পৰমাণুটোত ইলেক্ট্রনৰ মুঠ সংখ্যা কিমান হ’ব?
উত্তৰ:
K শ্বেলত থকা ইলেক্ট্রন সংখ্যা = $ 2n^2 $
= $ 2 \times 1^2 = 2 $
L শ্বেলত থকা ইলেক্ট্রনৰ সংখ্যা = $ 2n^2 $
= $ 2 \times 2^2 = 8 $
K আৰু L শ্বেলবােৰ পূৰ্ণ হৈ থাকিলে পৰমাণুটোত থকা মুঠ ইলেক্ট্রনৰ সংখ্যা হব = $ 2 + 8 = 10 $ টা।
প্ৰশ্ন 11: ক্ল’ৰিণ, ছালফাৰ আৰু মেগনেছিয়ামৰ যােজ্যতা কেনেদৰে পাবা?
উত্তৰ:
- ক্ল’ৰিণ (Cl):
ইলেক্ট্রন বিন্যাস = 2, 8, 7
যােজ্যতা = $ 8 – 7 = 1 $ - ছালফাৰ (S):
ইলেক্ট্রন বিন্যাস = 2, 8, 6
যােজ্যতা = $ 8 – 6 = 2 $ - মেগনেছিয়াম (Mg):
ইলেক্ট্রন বিন্যাস = 2, 8, 2
যােজ্যতা = $ 8 – 6 = 2 $
প্ৰশ্ন 12: যদি পৰমাণু এটাত ইলেক্ট্রনৰ সংখ্যা ৪ আৰু প্ৰটিনৰ সংখ্যাও 8 হয় তেন্তে—
(i) পৰমাণুটোৰ পাৰমাণৱিক সংখ্যা কি হ’ব?
(ii) পৰমাণুটোৰ আধান কিমান হ’ব?
উত্তৰ:
(i) পৰমাণু এটাত থকা প্ৰটিনৰ সংখ্যাই হ’ল পাৰমাণৱিক সংখ্যা। যিহেতু পৰমাণুটোত 8 টা প্ৰটন আছে, গতিকে ইয়াৰ পাৰমাণৱিক সংখ্যা হ’ব 8।
(ii) যিহেতু পৰমাণুটোত ইলেক্ট্রন আৰু প্ৰটিনৰ সংখ্যা সমান, গতিকে পৰমাণুটোৰ আধান শূণ্য হ’ব।
প্ৰশ্ন 13: তালিকা 4.1 ৰ সহায়ত অক্সিজেন আৰু ছালফাৰৰ পৰমাণুৰ ভৰ সংখ্যা উলিওৱা।
উত্তৰ:
- অক্সিজেন (O):
প্ৰটন = 8, নিউট্রন = 8
ভৰ সংখ্যা = $ 8 + 8 = 16 $ - ছালফাৰ (S):
প্ৰটন = 16, নিউট্রন = 16
ভৰ সংখ্যা = $ 16 + 16 = 32 $
প্ৰশ্ন 14: চিহ্ন H, D আৰু T প্ৰতিটোতে পােরা উপ-পাৰমাণৱিক কণাবােৰ তালিকাভূক্ত কৰা।
উত্তৰ:
| চিহ্ন | প্ৰটন | নিউট্রন | ইলেক্ট্রন |
|---|---|---|---|
| H | 1 | 0 | 1 |
| D | 1 | 1 | 1 |
| T | 1 | 2 | 1 |
প্ৰশ্ন 15: একোযযাৰকৈ সমস্থানিক আৰু সমভাৰীৰ ইলেক্ট্রনীয় বিন্যাস লিখা।
উত্তৰ:
- সমস্থানিক (Isotopes):
$ ^{12}C_6 $: ইলেক্ট্রন বিন্যাস = 2, 4
$ ^{14}C_6 $: ইলেক্ট্রন বিন্যাস = 2, 4 - সমভাৰী (Isobars):
$ ^{22}Ne_{10} $: ইলেক্ট্রন বিন্যাস = 2, 8
$ ^{22}Ne_{11} $: ইলেক্ট্রন বিন্যাস = 2, 8, 1
প্ৰশ্ন 16: ইলেক্ট্রন, প্ৰটন আৰু নিউট্রন ধর্মসমূহ তুলনা কৰা।
উত্তৰ:
| উপপৰামাণৱিক কণা | আধানৰ প্ৰকৃতি | ভৰ | অৱস্থান |
|---|---|---|---|
| ইলেক্ট্রন | ঋণাত্মক | $ 9 \times 10^{-31} $ kg | নিউক্লিয়াছৰ চাৰিওফালে |
| প্ৰটন | ধণাত্মক | $ 1.672 \times 10^{-27} $ kg | নিউক্লিয়াছ |
| নিউট্রন | প্ৰশম | প্ৰটনৰ ভৰৰ সমান | নিউক্লিয়াছ |
প্ৰশ্ন 17: জে জে থমছনৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি?
উত্তৰ:
- থমছনৰ আৰ্হিয়ে পৰমাণুবােৰ বৈদ্যুতিকভাৱে প্ৰশম বুলি প্ৰমাণ কৰিব পাৰিছিল, যদিও ৰাডাৰফৰ্ডৰ আৰ্হিৰ দৰে ফলাফল পােৱা নাযায়।
- থমছনৰ আৰ্হিৰ কোনাে ধৰণৰ প্ৰমাণিক ৰূপ পােৱা নাযায়।
প্ৰশ্ন 18: ৰাডৰফ ‘র্ডৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি?
উত্তৰ:
- ৰাডৰফৰ্ডৰ আৰ্হিৰ পৰা বৃত্তকাৰ কক্ষপথত ইলেক্ট্রনৰ পৰিভ্ৰমণ সুস্থিৰ হােৱা আশা কৰা নাযায়।
- এই আৰ্হিমতে, বৃত্তাকাৰ কক্ষপথত ইলেক্ট্রনৰ ত্বৰণ ঘটে, আৰু ত্বৰণৰ সময়ত আধানযুক্ত কণাই শক্তি বিকিৰণ কৰে। ফলত ইলেক্ট্রনে শক্তি হেৰুৱাব আৰু নিউক্লিয়াছত পতিত হ’ব।
প্ৰশ্ন 19: ব’ৰৰ পৰমাণু আৰ্হিটো বর্ণনা কৰা।
উত্তৰ:
- পৰমাণুৰ কেন্দ্ৰৰ চাৰিওফালে কিছুমান বিচ্ছিন্ন কক্ষপথ আছে, য’ত ইলেক্ট্রনবােৰে সুস্থিৰভাৱে থাকে।
- সুস্থিৰ কক্ষপথত থকা ইলেক্ট্রনবােৰে শক্তি বিকিৰণ নকৰে।
- কক্ষপথবােৰক K, L, M, N… বা 1, 2, 3, 4… সংখ্যাৰ দ্বাৰা বুজোৱা হয়।
আপোনাৰ প্ৰশ্নবোৰৰ সমাধান আৰু ব্যাখ্যা তলত দিয়া হৈছে।
6. প্রথম ওঠৰ টা মৌলৰ কাৰণে বিভিন্ন শ্বেত ইলেক্ট্রন বণ্টনৰ নিয়মবােৰ সংক্ষেপে লিখা।
উত্তৰ:
- ইলেক্ট্রনৰ সর্বোচ্চ সংখ্যা (2n²):
পৰমাণুৰ প্ৰতিটো কক্ষপথত থকা ইলেক্ট্রনৰ সর্বোচ্চ সংখ্যা হ’ল $ 2n^2 $, য’ত $ n $ হ’ল কক্ষপথৰ ক্ৰমিক সংখ্যা।
- প্ৰথম কক্ষপথ (K): $ n = 1 $ ⇒ $ 2 \times 1^2 = 2 $ টা ইলেক্ট্রন।
- দ্বিতীয় কক্ষপথ (L): $ n = 2 $ ⇒ $ 2 \times 2^2 = 8 $ টা ইলেক্ট্রন।
- তৃতীয় কক্ষপথ (M): $ n = 3 $ ⇒ $ 2 \times 3^2 = 18 $ টা ইলেক্ট্রন।
- বহিৰতম কক্ষপথৰ ইলেক্ট্রন:
পৰমাণুৰ বহিৰতম কক্ষপথত সর্বোচ্চ $ 8 $ টা ইলেক্ট্রন থাকিব পাৰে (অষ্টক নিয়ম)। - কক্ষপথৰ পূৰ্ণ হোৱা ক্ৰম:
পৰমাণুৰ কক্ষপথবোৰ ইহঁতৰ শক্তিৰ ক্ৰম অনুসৰি পূৰ্ণ হয়। কম শক্তিৰ কক্ষপথ প্ৰথমে পূৰ্ণ হয়, তাৰ পিছত ওপৰৰ কক্ষপথলৈ গতি কৰে।
7. ছিলিকন আৰু অক্সিজেনক উদাহৰণ হিচাপে লৈ যােজ্যতাৰ সংজ্ঞা দিয়া।
উত্তৰ:
- যােজ্যতাৰ সংজ্ঞা:
পৰমাণুৰ বহিৰতম কক্ষত থকা ইলেক্ট্রনবােৰক যােজ্যতা ইলেক্ট্রন বােলে। এই ইলেক্ট্রনবােৰৰ সংখ্যাৰ ওপৰত ভিত্তি কৰি পৰমাণুৰ যােজ্যতা নিৰ্ণয় হয়। - অষ্টক নিয়ম মতে, পৰমাণুৰ বহিৰতম কক্ষপথত $ 8 $ টা ইলেক্ট্রন থাকিলে ই সুস্থিৰ হয়।
- যদি বহিৰতম কক্ষত $ 4 $ টাতকৈ কম ইলেক্ট্রন থাকে, তেন্তে ইলেক্ট্রন এৰি দিয়া হয়। যদি $ 4 $ টাতকৈ বেছি থাকে, তেন্তে ইলেক্ট্রন গ্ৰহণ কৰা হয়।
- উদাহৰণ:
- ছিলিকন (Si):
ইলেক্ট্রনীয় বিন্যাস: $ 2, 8, 4 $
যােজ্যতা: $ 4 $ (কাৰণ বহিৰতম কক্ষত $ 4 $ টা ইলেক্ট্রন আছে)।
ছিলিকনে অষ্টক নিয়ম মানি চাৰিটা ইলেক্ট্রন ভাগ-বতৰা কৰি সহযােজী বান্ধনি গঠন কৰে। - অক্সিজেন (O):
ইলেক্ট্রনীয় বিন্যাস: $ 2, 6 $
যােজ্যতা: $ 2 $ (কাৰণ বহিৰতম কক্ষত $ 6 $ টা ইলেক্ট্রন আছে, আৰু ই $ 2 $ টা ইলেক্ট্রন গ্ৰহণ কৰি $ 8 $ টা ইলেক্ট্রন সম্পূৰ্ণ কৰে)।
8. উদাহৰণেৰে সৈতে ব্যাখ্যা কৰা।
(i) পাৰমাণৱিক সংখ্যা:
- সংজ্ঞা:
পৰমাণুৰ নিউক্লিয়াছত থকা প্ৰটনৰ সংখ্যাকে পাৰমাণৱিক সংখ্যা বােলে। - পাৰমাণৱিক সংখ্যা ($ Z $) = প্ৰটনৰ সংখ্যা।
- উদাহৰণ:
- হাইড্ৰজেন (H): প্ৰটনৰ সংখ্যা = $ 1 $ ⇒ পাৰমাণৱিক সংখ্যা $ Z = 1 $।
- কাৰ্বন (C): প্ৰটনৰ সংখ্যা = $ 6 $ ⇒ পাৰমাণৱিক সংখ্যা $ Z = 6 $।
(ii) ভৰ সংখ্যা:
- সংজ্ঞা:
পৰমাণুৰ নিউক্লিয়াছত থকা প্ৰটন আৰু নিউট্রনৰ মুঠ সংখ্যাৰ যােগফলকে ভৰ সংখ্যা বােলে। - ভৰ সংখ্যা ($ A $) = প্ৰটনৰ সংখ্যা + নিউট্রনৰ সংখ্যা।
- উদাহৰণ:
- কাৰ্বন (C): প্ৰটন = $ 6 $, নিউট্রন = $ 6 $ ⇒ ভৰ সংখ্যা $ A = 6 + 6 = 12 $।
- আর্গন (Ar): প্ৰটন = $ 18 $, নিউট্রন = $ 22 $ ⇒ ভৰ সংখ্যা $ A = 18 + 22 = 40 $।
(iii) সমস্থানিক:
- সংজ্ঞা:
একে মৌলৰ বেলেগ বেলেগ পৰমাণুবােৰৰ পাৰমাণৱিক সংখ্যা একে, কিন্তু ভৰ সংখ্যা বেলেগ হ’লে সিহঁতক সমস্থানিক বােলে। - উদাহৰণ:
- কাৰ্বনৰ সমস্থানিক:
- $ ^{12}C_6 $: প্ৰটন = $ 6 $, নিউট্রন = $ 6 $, ভৰ সংখ্যা = $ 12 $।
- $ ^{14}C_6 $: প্ৰটন = $ 6 $, নিউট্রন = $ 8 $, ভৰ সংখ্যা = $ 14 $।
(iv) সমভাৰী:
- সংজ্ঞা:
বেলেগ বেলেগ পাৰমাণৱিক সংখ্যাৰ পৰমাণুবােৰৰ ভৰ সংখ্যা একে হ’লে সিহঁতক সমভাৰী বােলে। - উদাহৰণ:
- $ ^{22}Ne_{10} $: প্ৰটন = $ 10 $, নিউট্রন = $ 12 $, ভৰ সংখ্যা = $ 22 $।
- $ ^{22}Na_{11} $: প্ৰটন = $ 11 $, নিউট্রন = $ 11 $, ভৰ সংখ্যা = $ 22 $।
সমস্থানিকৰ দুটা ব্যৱহাৰ:
- ইউৰেনিয়ামৰ সমস্থানিক ($ ^{235}U $):
নিউক্লিয়াৰ ৰিয়েক্টৰত ব্যৱহাৰ কৰা হয়। - ক’বাল্টৰ সমস্থানিক ($ ^{60}Co $):
কৰ্কট ৰােগৰ চিকিৎসাত ব্যৱহাৰ কৰা হয় (ৰেডিওথেৰাপীত)।

